顕微鏡画像のみを使用するシグナルパスウェイ解析
公開:2023.09.29
新薬のターゲット探索や作用機序解明には、薬剤添加による細胞内情報伝達すなわちシグナル伝達系(シグナルパスウェイ)の変化を正確にとらえることが不可欠です。シグナル伝達系は、細胞膜脂質ラフトや核などの特定の場所を介して制御されています。加えて近年では、液-液相分離により形成されるタンパク質の集合体(ドロプレット)が、シグナルの増減や分岐に関与しているという報告もあります。しかし、一般的な生化学分析ではタンパク質局在を解析することが困難であり、これが薬剤の作用機序の解明が難しいという創薬課題の一因になっています。
これに対して、顕微鏡画像からは、タンパク質局在の時空間的な挙動を詳細に定量化することが可能です。この顕微鏡の特性を利用して、薬剤添加により活性化/不活性化するシグナル伝達系を、顕微鏡画像のみに基づいて推定する技術が「PLOM-CON解析法」※1 です。ニコンでは、この手法を活用してお客様のサンプルの画像取得・画像処理・解析までを受託して行う「シグナルパスウェイ解析サービス」をご提供しています。
※1) PLOM-CON解析法(Protein Localization and Modification-based Covariation Network analysis method):東京工業大学 科学技術創成研究院 細胞制御工学研究センターの加納ふみ准教授、中津大貴助教、國重莉奈特任助教、および東京大学 大学院総合文化研究科の村田昌之教授(現 東京工業大学特任教授、東京工業大学マルチモーダル細胞解析協働研究拠点拠点長、東京大学名誉教授)、野口誉之助教(現 東京大学IRCN) の研究グループとの共同開発
解析事例のアプリケーションノート「顕微鏡画像のみからシグナル伝達系を推定する手法を用いたインスリン応答系の解析」のダウンロードはこちら
目次
1画像によるシグナルパスウェイ解析の特長
タンパク質同士が細胞内のどの場所(細胞質、核、オルガネラ、足場タンパクなど)を介して相互関係を有しているのかを、数十種類のタンパク質について可視化します。これにより以下の予測が可能となり、薬剤作用機序の解析、ターゲット探索、毒性原因の研究を強力にサポートします。
-
活性化が示唆されるシグナル伝達系
-
中心となって活動している/薬剤のターゲットとなるタンパク質
-
特定の細胞内区画(細胞質、核、オルガネラ、足場タンパクなど) に局在するタンパク質群により制御されているシグナル伝達系
2画像によるシグナルパスウェイ解析の原理
- 顕微鏡画像から、細胞内区画(図1(A)~(D))とタンパク質(シグナル分子)の集合体(図1(E))をニコン独自の画像解析ソフトウエアにより自動検出します。
- 細胞内区画ごとに、各タンパク質の蛍光強度およびタンパク質集合体の形態を、薬剤による細胞刺激後から経時的に測定し、細胞内区画が介在するタンパク質同士の相関性を分析します。図2(A)では、タンパク質Aの細胞質内での挙動と、タンパク質BのActin集合体内での挙動が相関していることが検出されています。
- この結果をネットワーク図(共変動ネットワークと呼称します)として表現します(図2(B))。
タンパク質名の記載された円(ノード)がタンパク質を表し、線(エッジ)で繋がれたタンパク質同士は相関性があることを示します。また、エッジの端の色付きの点は、タンパク質の活動場所である細胞内区画を表しています。これにより、タンパク質同士が細胞内のどの場所(細胞質、核、オルガネラ、足場タンパク質など)を介して他のタンパク質と相関しているのかが可視化できます。さらに、エッジの本数の多い、すなわち多くのタンパク質と相関しているタンパク質は、大きな円で表示されます。
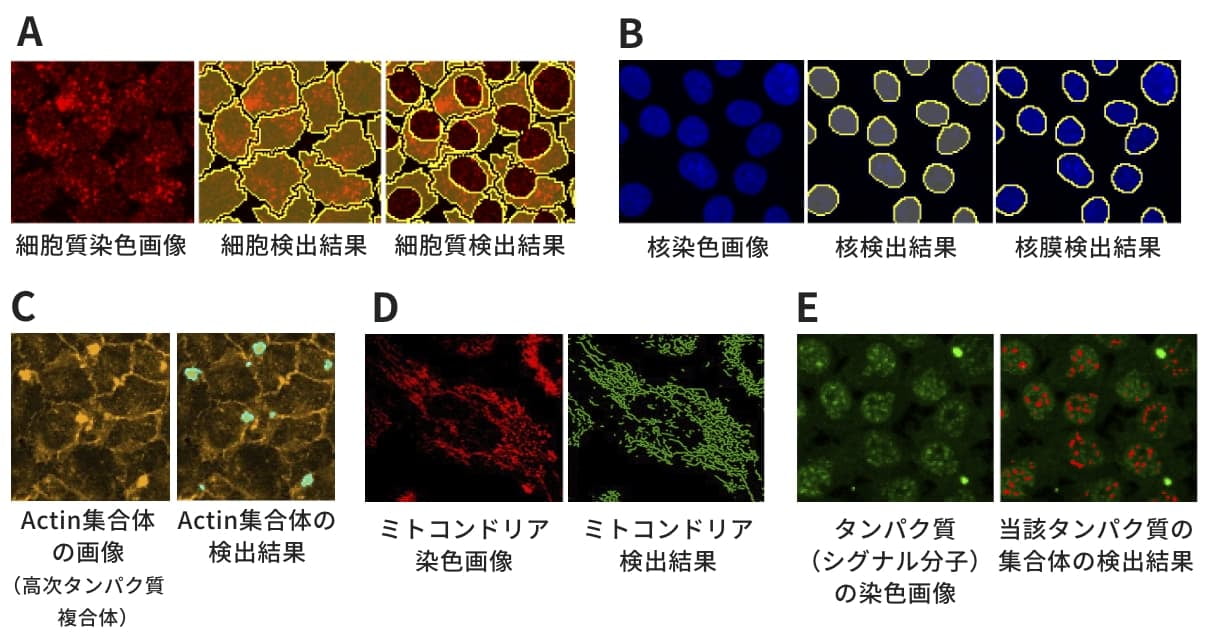
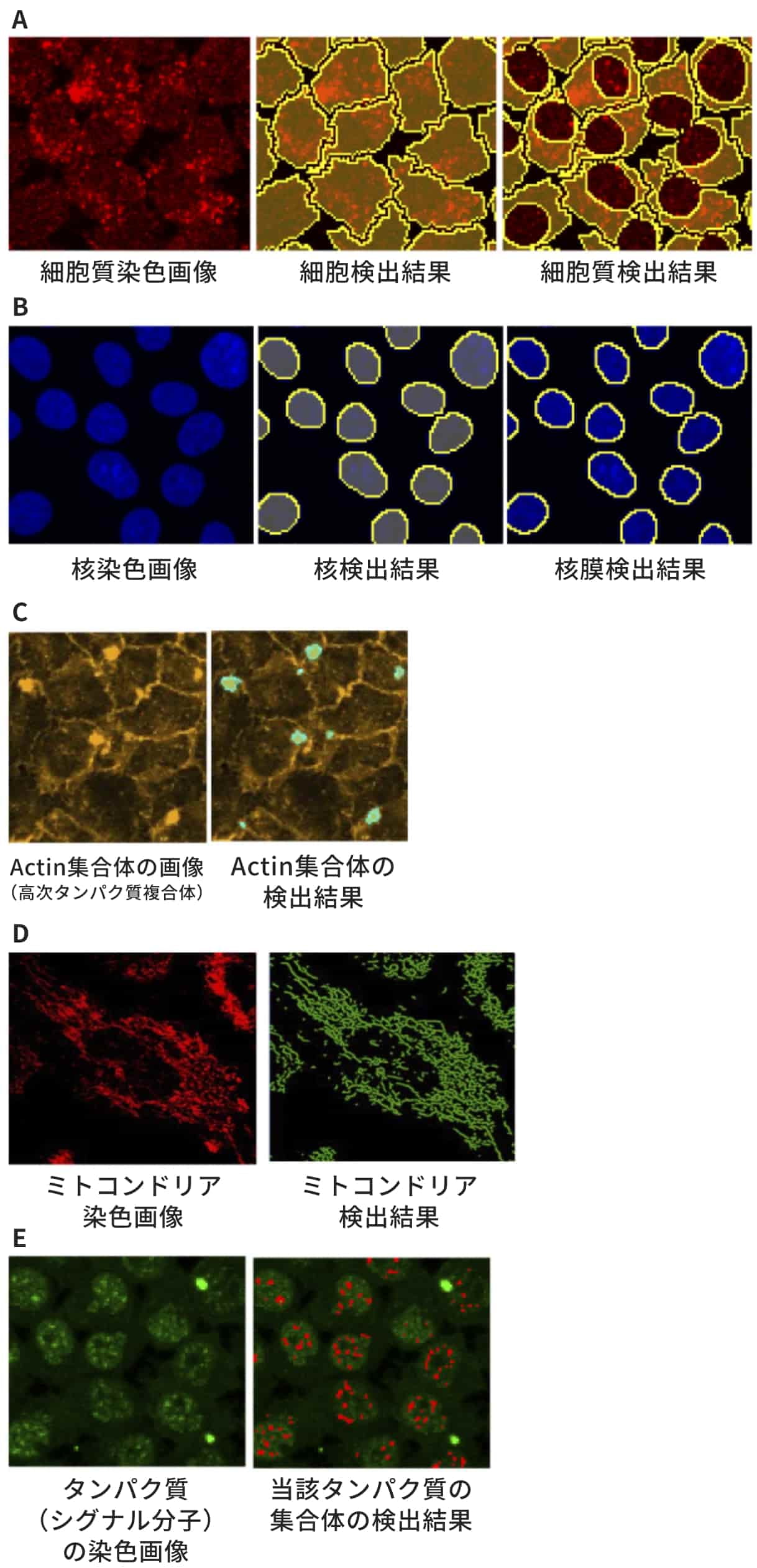
図1. 細胞内区画(A)~(D)とタンパク質集合体(E)の検出例(A) GAPDHなどのハウスキーピング酵素で蛍光染色して撮影し、細胞と細胞質を検出。(B) ヘキストもしくはDAPIで蛍光染色して撮影し、核と核膜を検出。(C) Actin集合体を蛍光染色して撮影し、その集合体を検出。
本例では、Actin集合体は高次タンパク質複合体を形成し、シグナル伝達の足場として機能していることが示唆されている。(D) オルガネラをマーカーで蛍光染色して撮影し、オルガネラを検出。(E) シグナル伝達系を構成するタンパク質を蛍光染色して撮影し、タンパク質の集合体を検出。
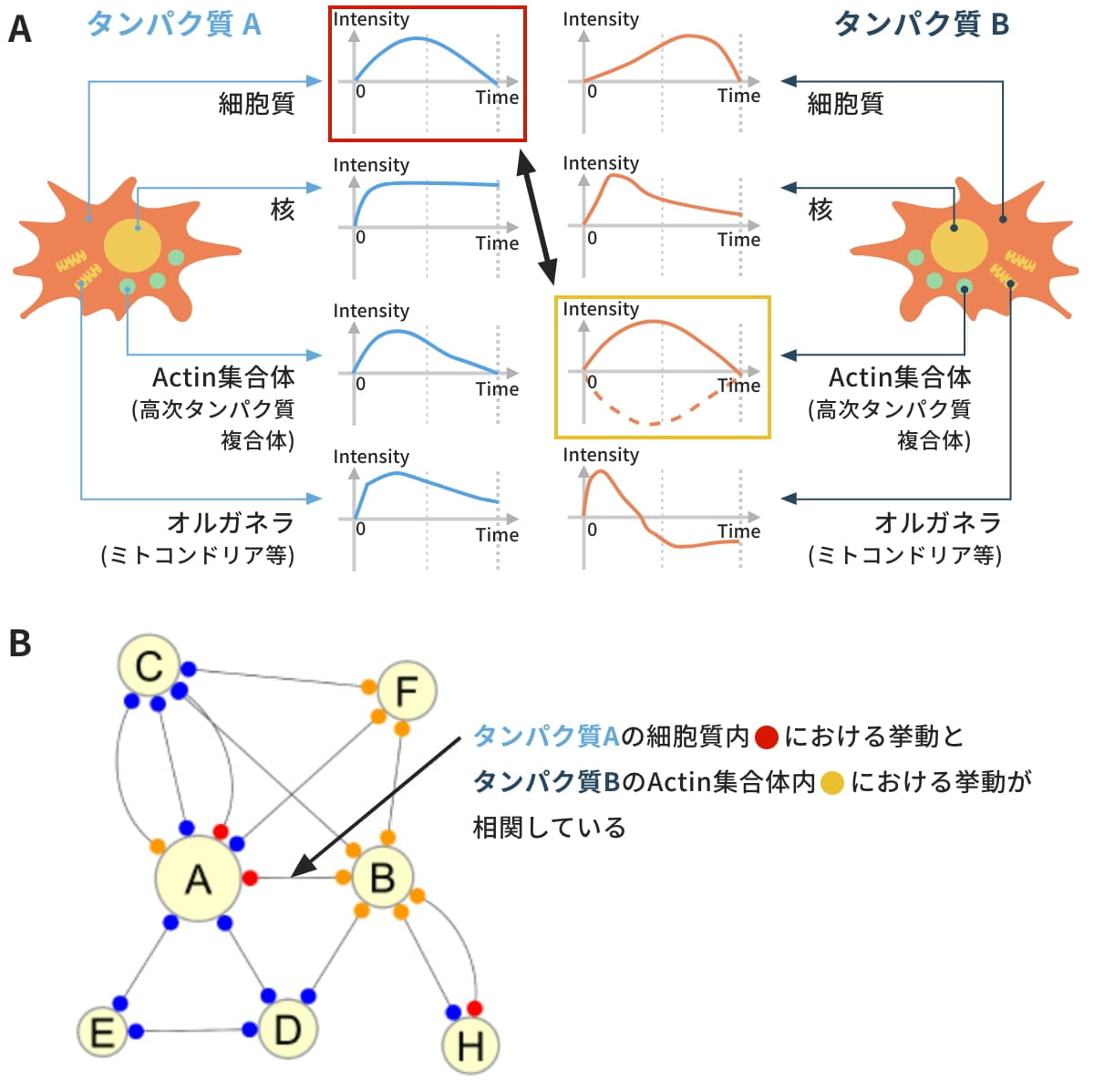
図2. 共変動ネットワーク解析法の概要図(A) タンパク質挙動の相関関係の検出(B) 検出した相関関係の可視化
3共変動ネットワークから解ること
図3は、ラット肝がん由来の培養細胞 H4ⅡEC3にインスリン刺激を行った際の共変動ネットワークの例です。エッジ端点の色は、青が核を、赤が細胞質を、オレンジがActin集合体を表しています。
- 活性化が示唆されるシグナル伝達系の予測
図3(A)の青枠と(B)からは、血糖値コントロールに関係するタンパク質群間のエッジが密であることがわかります。これは、血糖値コントロールのシグナル伝達系が活性化されていることを示唆しています。
- 中心となって活動しているタンパク質の予測
図3(B)では、Akt(pSer473)を示す円①のサイズが一番大きく表示されており、Akt(pSer473)が中心となって活動していることが示唆されます。
- 特定の細胞内区画に局在するタンパク質群により制御されるシグナル伝達系の予測
図3(B)では、②のGSK3β(pSer9)が、オレンジ色で示されたActin集合体内でのみ活動しており、Actin集合体を介して①のAkt(pSer473)と関係を持っていることが示唆されます③。これは、Akt(pSer473)とGSK3β(pSer9)が関与する経路、すなわちグリコーゲン合成の経路がActin集合体で生起していることを示唆しています。
本例の詳細は、解析事例のアプリケーションノート「顕微鏡画像のみからシグナル伝達系を推定する手法を用いたインスリン応答系の解析」をご参照ください。
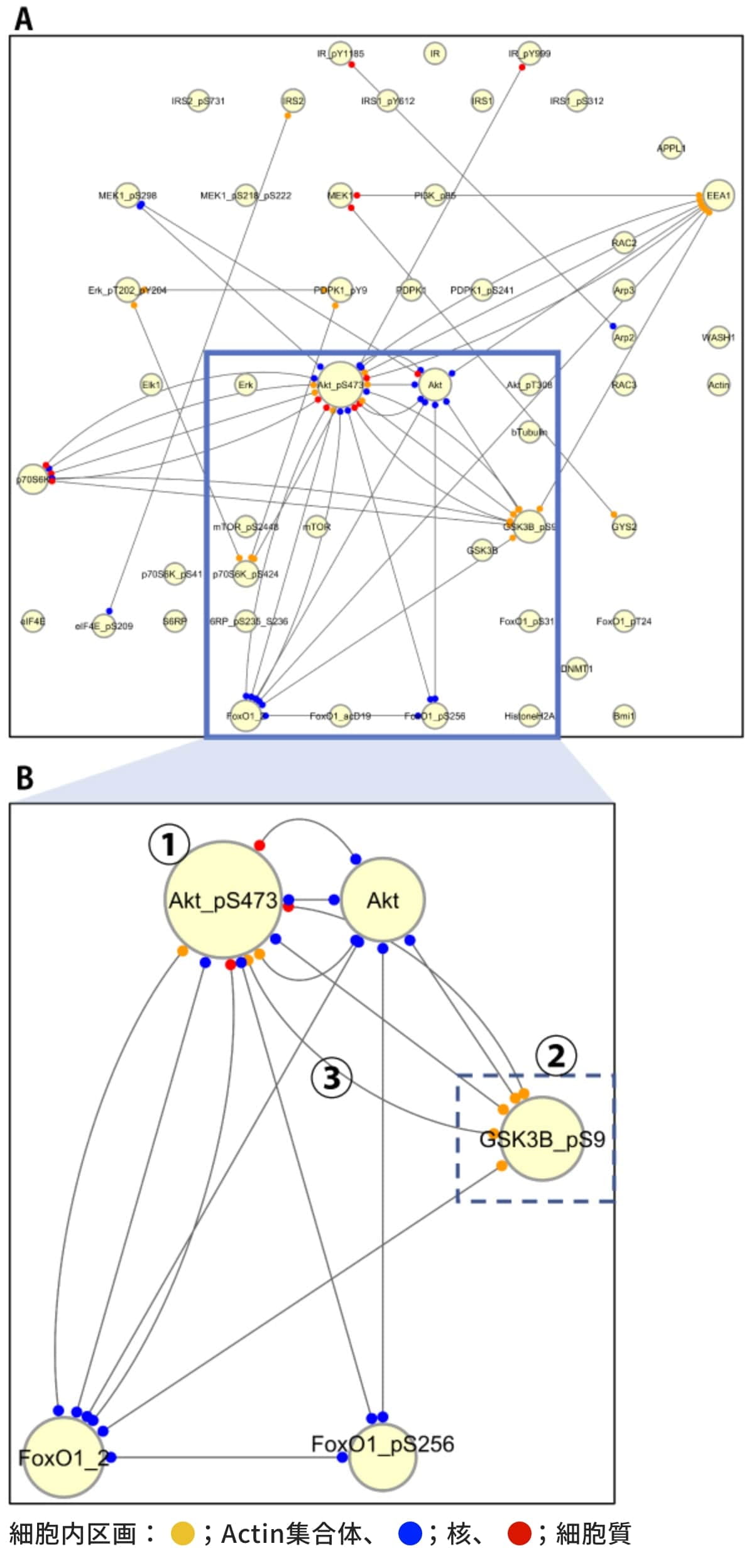
図3. 共変動ネットワーク図の例(A) インスリン応答シグナル伝達に関わる50種のタンパク質で構成される共変動ネットワーク。
血糖値コントロール関連のタンパク質群間のエッジが密であることがわかる。(B) (A)の青枠部分(エッジが密な部分)の拡大図。
- 強く活性化されているシグナル伝達系の抽出
タンパク質間の相関性の計算にはスパースモデリングを使用します(図4)。この計算式のρ値を高くすることにより、強く相関する(強く活性化されている)シグナル伝達系が抽出されます。これにより、複数のターゲットを持つ化合物でも、注目すべきタンパク質間の関係を抽出できます。
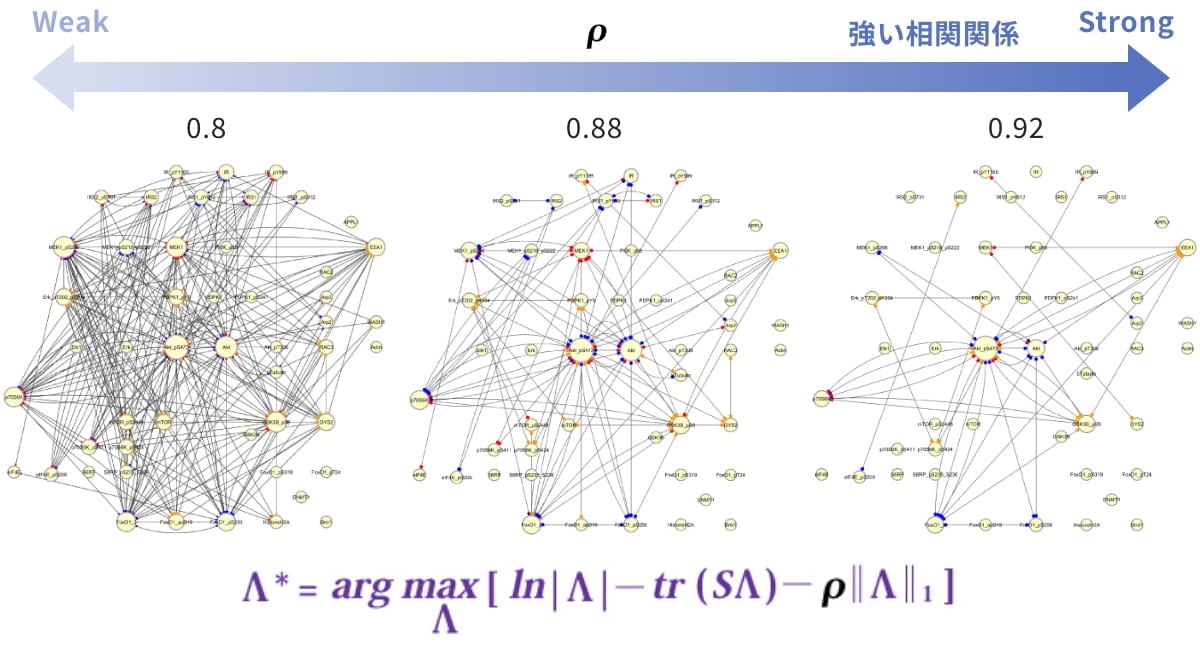
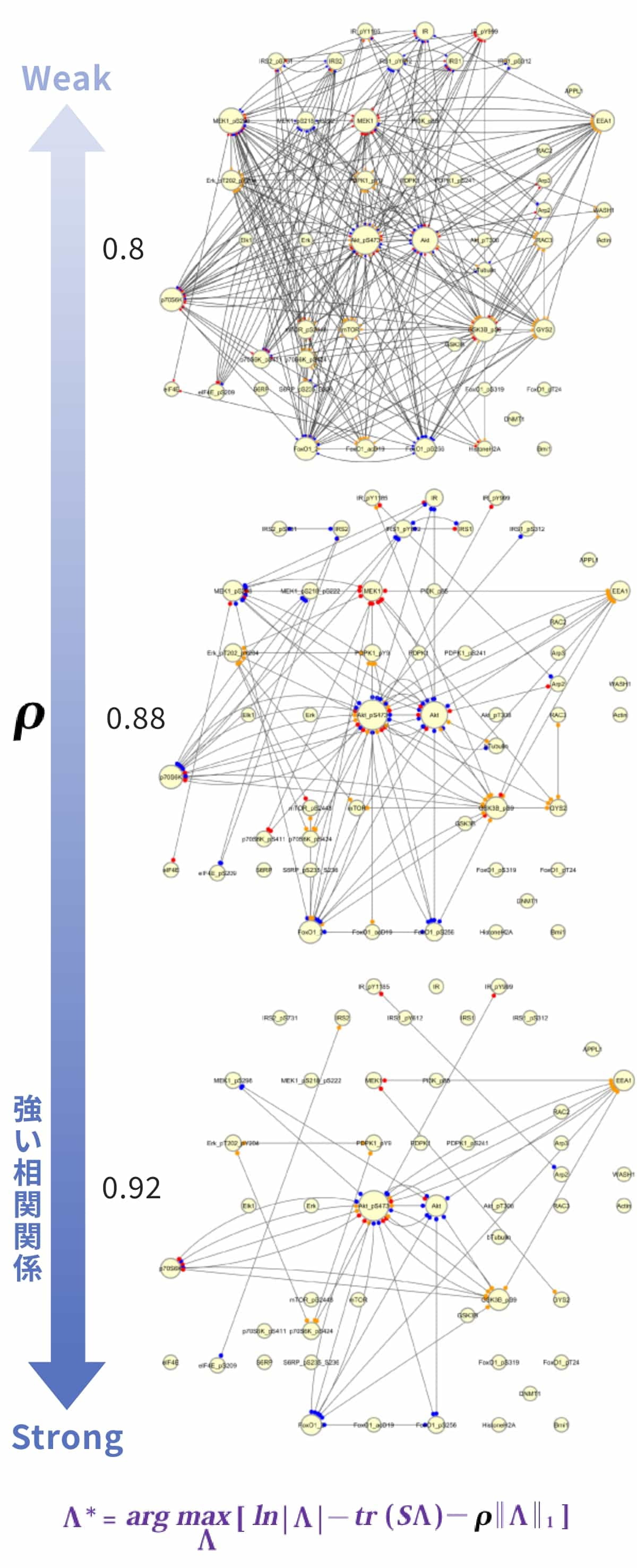
図4. スパースモデリングによる相関性の計算
- タンパク質挙動の時間変化の確認
また、タンパク質の挙動を時間変化グラフで確認することで、エッジを形成するタンパク質間の関係性をさらに深く考察できます。
図5(A)では、Akt(pSer473)とFoxO1(pSer256)が核内で関係を持っていることが分かりますが、そのエッジがどのようなデータに基づいて生成されているのかを、時間変化グラフ(図5(B))により確認できます。このグラフでは、Akt(pSer473)の核内輝度値(核内の発現量)が上昇し、同じタイミングでFoxO1(pSer256)集合体(図5(C))の核内の量(総面積)が減少しています。インスリン刺激によりAkt(pSer473)が核内に移行しFoxO1(pSer256)が核外にくみ出されることで、糖新生が抑制されることが知られていますが、その知見と合致しています。加えて、FoxO1(pSer256)が核内で集合体を形成し糖新生を制御している(図5(D)の赤矢印)という新しい知見を示唆しています。
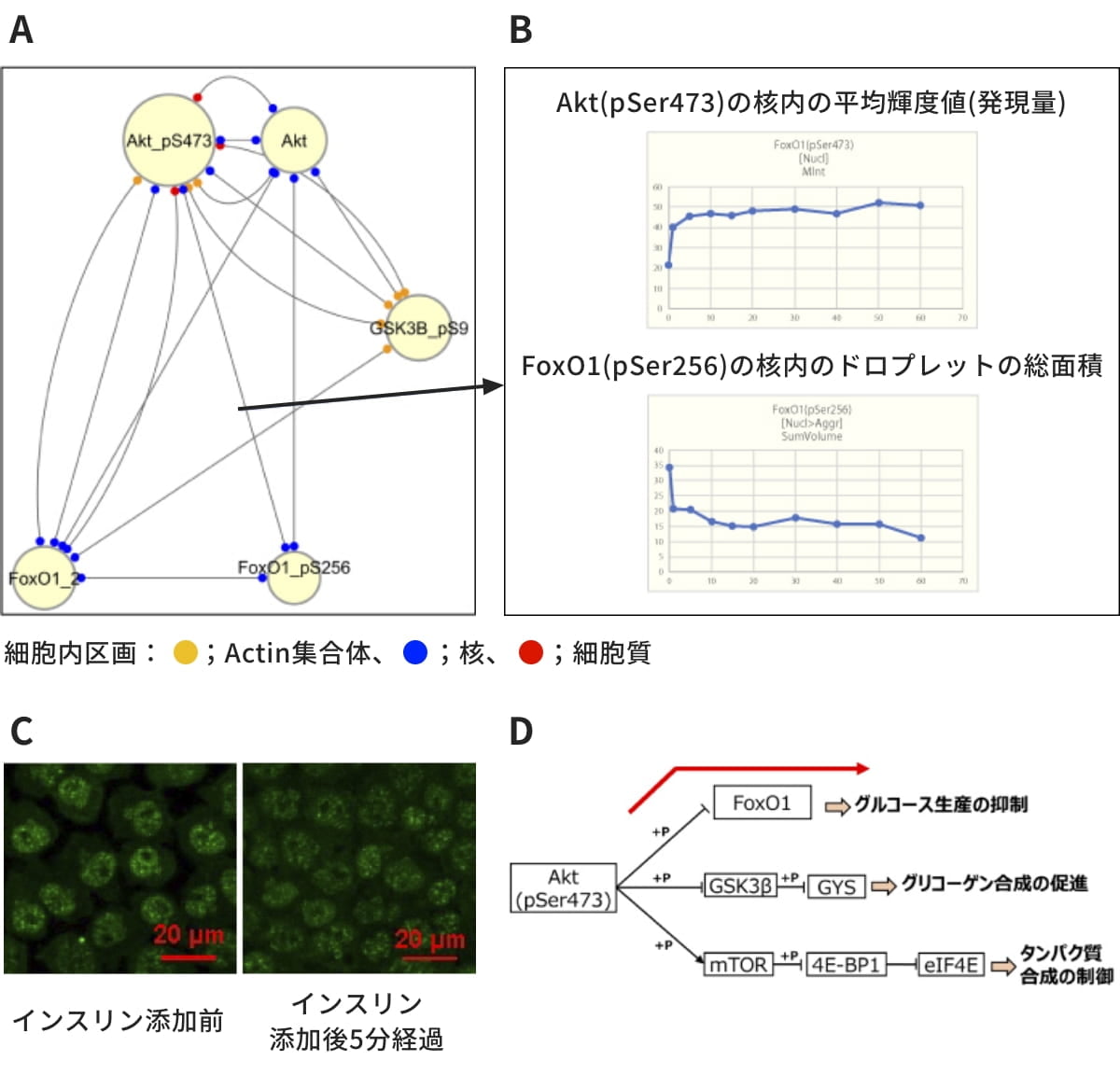
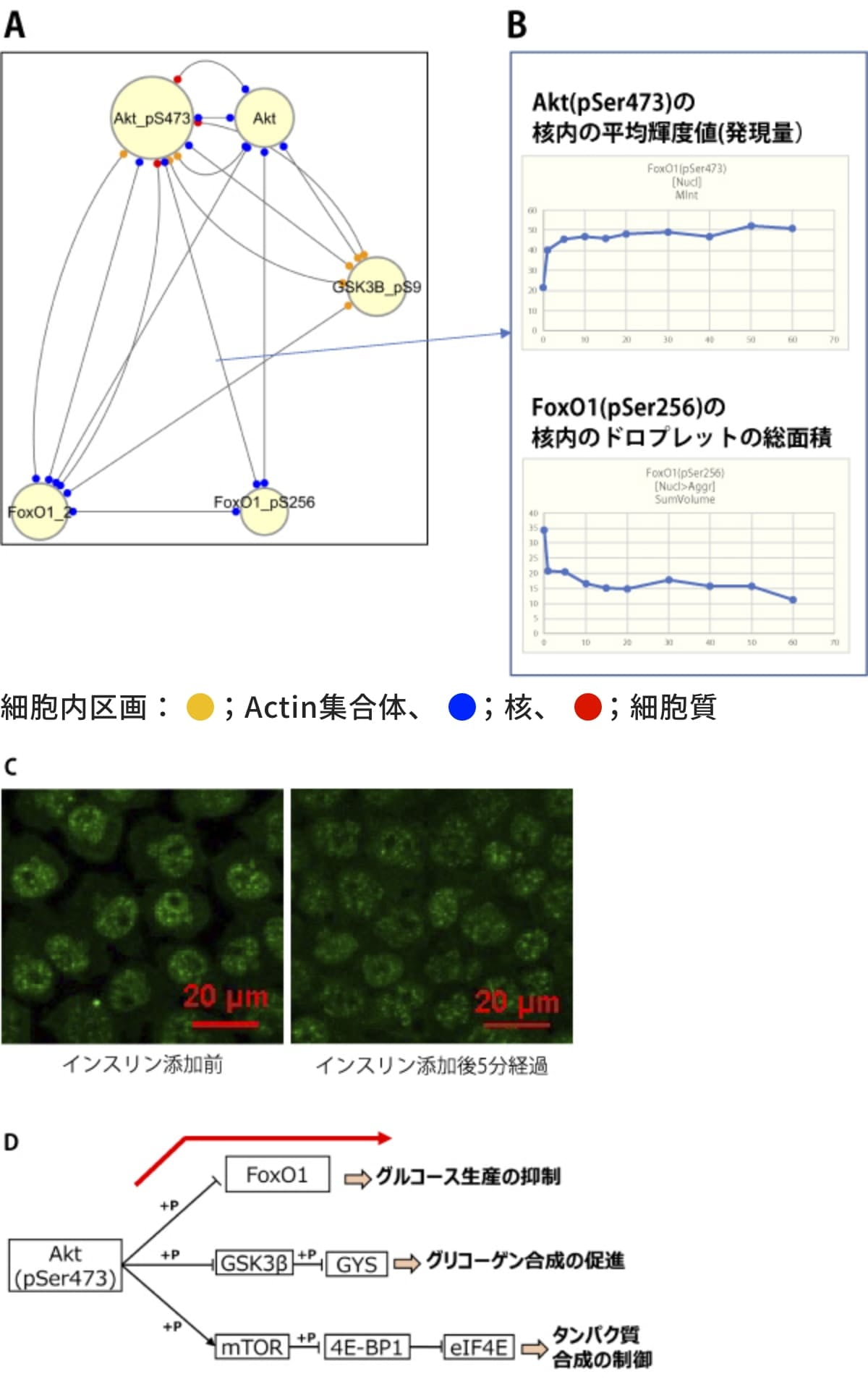
図5. タンパク質挙動の時間変化の確認 (CK666(-))(A) インスリン刺激時の共変動ネットワークのうち、エッジの密な部分を拡大表示。(B) Akt(pSer473)とFoxO1(pSer256)の核内における時間変化グラフ。
横軸:インスリン添加後の時間経過。(C) FoxO1(pSer256)の共焦点顕微鏡画像。
インスリン添加前(左)およびインスリン添加後5分(右)。
核内で集合体を形成している。インスリン添加によりFoxO1(pSer256)集合体の総面積が時間とともに減少している。(D) 既知のインスリンシグナル伝達系の模式図。(B)のグラフから、インスリン刺激時の糖新生抑制の経路(赤矢印)に、FoxO1(pSer256)集合体が関与していることが示唆された。
主な解析例
- インスリンシグナル伝達経路
- PI3K-Akt
- mTOR経路によるタンパク質合成の促進
- Wnt/β-cateninシグナリング
- MEK/ERK経路(MAPK(増殖))
- MAKP(ストレス)
- ストレス応答(ERストレス、酸化ストレス)
- JAK-STAT
- PKCシグナリングによる増殖抑制
- Smadシグナリング
- エネルギー代謝(解糖系)
- エネルギー代謝(TCA回路)
- エネルギー代謝(ワールブルク効果)
- Hippoシグナリング
- NF-kB
- 細胞周期
- 細胞接着
- 細胞骨格制御
- 細胞内輸送
- 低酸素シグナリング
- EMT
- オートファジー
4まとめ
- PLOM-CON解析法では、薬剤添加により活性化/不活性化するシグナル伝達系を顕微鏡画像のみに基づいて推定することが可能です。
- ニコンは、PLOM-CON解析法を活用し、お客様のサンプルから、細胞内区画に局在するタンパク質群により制御されるシグナル伝達系を推定する、「シグナルパスウェイ解析サービス」をご提供しています。
- 本サービスは、抗がん剤などの作用機序研究への適用実績があります。
参考文献
Noguchi et al.,
iScience 24, 102724, 2021
野口 誉之1 ,加納 ふみ2 , 米谷 信彦3 ,岩本 智沙子3 ,山﨑 聖子4 ,大坪 洋介4 ,中津 大貴2 ,國重 莉奈1,2 ,村田 昌之1,2,*
1.東京大学 大学院総合文化研究科 広域科学専攻 生命環境科学系, 2.東京工業大学 科学技術創成研究院 細胞制御工学研究センター, 3.株式会社ニコン ヘルスケア事業部, 4. 株式会社ニコン 先進技術開発本部



