顕微鏡による、細胞の各種観察方法
公開:2020.03.11
培養細胞を観察する場合、細胞そのものは生きているため、非侵襲的に細胞を観察することが重要となります。ここでは、光学的観察方法のうち代表的なものを紹介し、それぞれの留意点を解説します。
無染色法と蛍光染色法のメリット
基本的に細胞の顕微鏡観察法は、無染色法と蛍光染色法の2つに大別されます。
無染色法
無色透明な細胞標本を、染色せず透過光を照射して光の性質を利用して濃淡を付ける方法です。無染色法にも、相差観察法、微分干渉観察法、変調コントラスト法などの方法があります。
無染色透過観察法は、細胞に蛍光色素を導入する蛍光観察法と比べて一般に非侵襲的であり、再生医療等においては、観察した細胞をそのまま次の工程に進めることができるという利点があります。
蛍光染色法
標本の観察対象部位に蛍光色素を導入し、対物レンズを通して照明光を照射して発生する蛍光をとらえて画像にする方法です。蛍光観察は蛍光標識を導入するため、ある程度侵襲的ではありますが、抗体染色等により細胞機能発現を可視化できるメリットがあります。
細胞培養時に用いる顕微鏡観察方法の種類
❶明視野観察(Bright Field Observation)
標本を透過光観察するもっとも基本的な観察方法です。画像のコントラストは光の透過率の差で表現され、色情報は透過してきた光の波長で表現されます。明視野観察を使用する目的は (1)位相差観察などのより詳細な観察の前段階として、おおよその細胞の位置や密度を把握する、 (2)病理標本など標本を染色して形態を把握することです。顕微鏡の光学構成としては最も基本的な構成です。
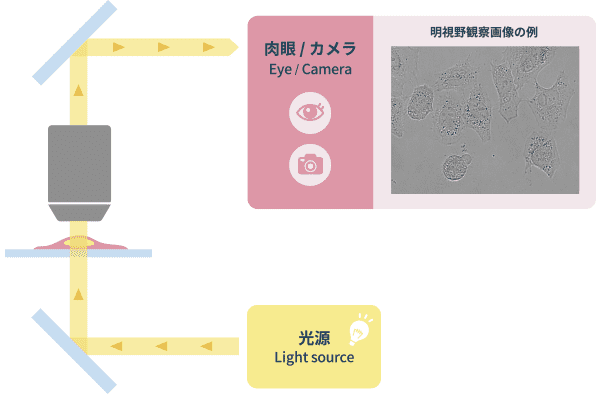
「明視野観察」の光学原理図と画像例
❷位相差観察(Phase Contrast Observation)
無色透明な培養細胞をコントラスト良く観察するのに適した観察方法です。細胞は透明ですが、光は標本を通過すると場所によって位相(光の波形の位置)が変化します。そこで照明光を工夫して、位相が変わらない「直接光」と、標本の形態によって位相が変わる「回折光」とに分けて像面で合成すると、波の干渉によりコントラストが強調されて標本の形態を表示します。結果として無色透明な培養細胞でも形態を認識できる画像が得られます。
位相差観察の特長は、濃淡に方向性が無いため画像の質が安定していることであり、そのため近年、顕微鏡像の画像解析用途に非常によく用いられています。欠点としてはハロと呼ばれる明るい縁取りが出てしまうことです。ニコンの開発した「アポダイゼーション位相差法」による位相差用対物レンズは、ハロを軽減し、近接した細胞でも明確な識別を可能にします。顕微鏡の構成としては、照明側のコンデンサと、レンズ内に位相リングと位相膜を配した位相差観察専用対物レンズが必要です。
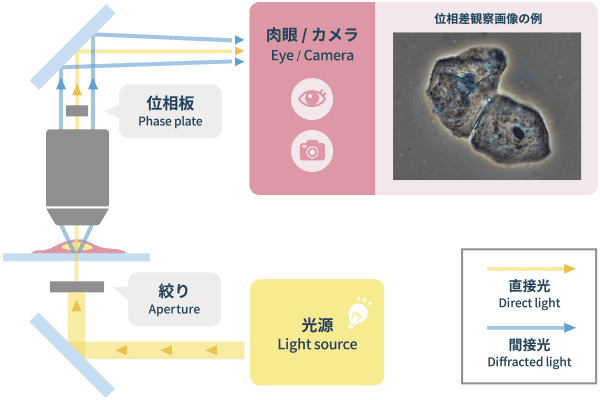
「位相差観察」の光学原理図と画像例
関連リンク
上記のような原理の撮影装置により取得した画像データから欲しい情報を取り出したり加工したりする画像解析技術について、培養細胞のケースに当てはめて分かりやすくご紹介します。また、画像解析をより円滑に進めやすくするための撮影時の留意点などもご紹介します。
細胞画像における画像解析画像解析に適した細胞の位相差画像撮影において留意すべきポイント❸微分干渉観察(Differential Interference Contrast Observation)
位相差観察と同様に位相物体である培養細胞をコントラスト良く観察するために工夫された観察方法です。偏光板を用いて照明光を直線偏光光とし、照明側に挿入されたプリズムによって光をわずかに離した2つの直線偏光の光線を作り出し、標本を照明します。標本を通過した2つの光線は観察側に挿入されたプリズムで再び合成されます。するとその2つの光線の通過した標本の位置(厚み)の差で位相のズレが生じ、合成した時の干渉でコントラストができます。この際、2つの光線の分離させる距離は光学解像度より小さくしているので像が二重になることはありません。画像は物体の片側が暗く、反対側が明るくなり立体的に見えますが、濃淡に方向性があることは画像解析には不利になります。
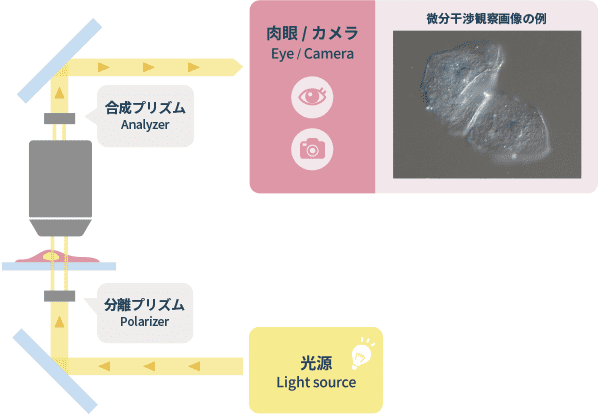
「微分干渉観察」の光学原理図と画像例
位相差のようにハロは発生しませんが、直線偏光を用いるためプラスチック容器は直線偏光を乱すため、この観察法には使えません。顕微鏡の構成としては照明側に偏光板(ポラライザー)と微分干渉プリズム、結像側に微分干渉プリズムと検光偏光板(アナライザー)が必要で、位相差用対物レンズは使えません。
❹変調コントラスト観察(Modulation Contrast Observation)
位相物体を可視化する観察方法です。照明の光路に光軸中心から離れた位置にスリットを入れた絞りを配置し、そのスリットを通過した斜めの照明光が標本を照射し、屈折率勾配のある光線を結像側に設けた変調板を通過させることで、像にコントラストを付けます。画像は微分干渉観察のような立体的に見える画像となります。位相差観察のようにハロもなく、直線偏光を用いないため、微分干渉観察では使用できないプラスチック容器も、この観察法では使用できます。ニコンでは独自に開発した技術によりNAMC(Nikon Advanced Modulation Contrast)シリーズとして製品化しています。
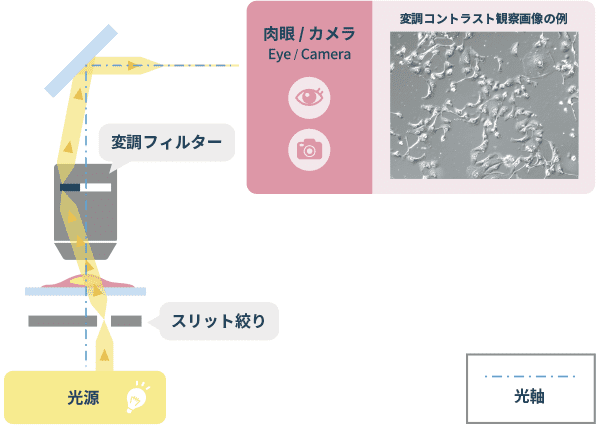
「変調コントラスト観察」の光学原理図と画像例
❺蛍光観察 (Fluorescence Observation)
免疫反応を利用し細胞の特定の部位を色素で染色し特定の部位のみを選択的に観察する方法です。蛍光色素内の蛍光分子は、励起光のエネルギーを吸収して基底状態に戻るときにエネルギーを光として放出する、蛍光現象を示します。この蛍光現象を利用したものに、対物レンズから励起光を照射し、発生する蛍光を同じ対物レンズで取得する、「落射蛍光照明法」があります。この照明方法では同じ光路を往復することになりますが、発生する蛍光の波長は励起光の波長より長くなる(ストークスシフト)ことを利用して、励起光と蛍光をダイクロイック(色分割)フィルターにより分離することができます。そこで、通過した光を画像化し、それを目視またはカメラで観察します。蛍光色素は様々な波長(色)のものがあり、複数の観察対象に異なる色で染色して多色の画像を得ることができます。しかしながら、標本を固定化した上で染色することが多く、生きた細胞に対して使用できる色素は限られます。
近年広く使用されている方法は、下村脩博士(物理学者)が2008年にノーベル化学賞を受賞した技術で、GFP(Green Florescent Protein)を代表とする蛍光タンパク質による標識です。これは観察したい部位の遺伝子に蛍光タンパク質の遺伝子を導入することで生体へのダメージを比較的抑えた形で標識でき、生きた細胞の動きを可視化することができます。発生する蛍光は励起光の数万分の1程度の強度しかないため、通常、高感度カメラで画像取得します。また対物レンズには、レンズ内の構造部材が自家蛍光を発しない、蛍光観察対応レンズが必要です。なお、プラスチック容器は自家蛍光を発するため、コントラストに影響を与える可能性があり、観察容器には適しません。
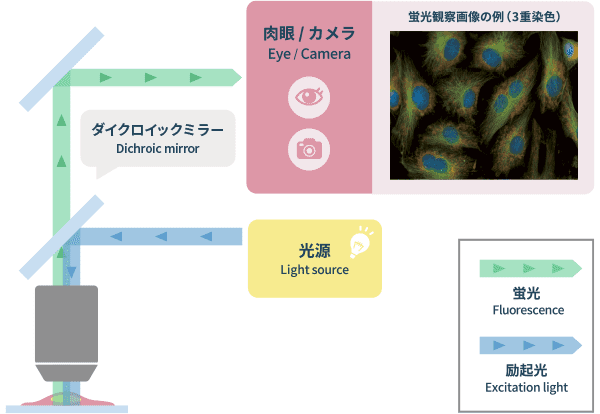
「蛍光観察」の光学原理図と画像例
意外と知らない生物顕微鏡の使い方:使用前調整や、清掃方法をガイド!

生物顕微鏡を正しく安全に使えていますか?
作業者ごとに合わせた使用前調整や、仕様ごとや定期的な清掃・消毒方法をチェックシート形式でご提供します。



