ユーザーインタビュー《ローツェライフサイエンス株式会社》膨大なデータを取得し、培養条件を最適化。「白斑治療用皮膚シートの生産性が約3倍向上し、汚染率も5桁減に」

ローツェライフサイエンス株式会社
主な事業内容
ライフサイエンス関連製品製造
お話いただいた方
代表取締役社長山﨑 幸登 さん
採用いただいた
機器・システム

半導体産業で培ったオートメーション技術をベースとして、創薬研究、iPS細胞研究、再生医療分野に貢献し続けるローツェライフサイエンス株式会社さま(以下、ローツェLS)。ニコンのBioStudio-miniは同社の自動培地交換機能付き細胞培養装置CellKeeperシリーズや自動観察装置CellShotシリーズに採用され、細胞培養プロセスの高精度な可視化を通じて、細胞培養手順の標準化づくりや、皮膚シートによる再生医療に貢献しています。同社代表の山﨑さんに、BioStudio-miniがお手伝いした発見やイノベーションについてお話を伺いました。
※本文中敬称略
目次
表示ローツェLSさまのイノベーション

山﨑 幸登 さん
細胞培養の自動化で標準化への道を拓く
御社は半導体製造装置にも応用されているメカトロニクス技術をベースに、創薬スクリーニングや再生医療分野の自動装置を開発・製品化していらっしゃいますね。ライフサイエンス分野に進出されたきっかけは何だったんですか?
山崎さん
私自身はもともと機械設計や装置開発が専門で、半導体製造装置の開発などを手がけていました。ライフサイエンス分野に携わるきっかけは、2002年に受託した「タンパク結晶化ロボットシステム」です。その後、創薬研究用のスクリーニング装置をつくらせていただきました。この技術をベースとして、2011年3月に細胞加工製品製造の自動化装置組織ファクトリー(T-Factory*)の開発に参画させていただくことになり、主に搬送の部分を担当しました。以来、これらの経験をベースに再生医療分野での自動培養装置の開発を行ってきました。*内閣府最先端研究開発支援(FIRST)プログラムの一つ。再生医療産業化に向けたシステムインテグレーションである臓器ファクトリーの創生組織ファクトリー (T-Factory)
未知の領域への進出だけにご苦労もあったのではないですか?
山崎さん
そうですね。細胞のサの字も知らない人間が培養装置をつくることになるわけですが、そもそも機械は最初はだいたい動かないんですよ。でも、われわれはとにかくあきらめずに、ちゃんと動くところまでやり通す。そうした姿勢が今につながってきたのではないかと思います。ニコンさんとのお付き合いもT-Factoryがきっかけですが、ニコンさんも含めて周りの方々に「われわれが分かっていない」ことを分かっていただき、いろいろなことを懇切丁寧に教えていただけたのはありがたかったですね。逆に、異分野から参入したわれわれの従来とは異なる発想も採用いただき、リーズナブルな開発ができたのではないかと思っています。
細胞シートの培養装置で白斑治療に貢献
T-Factoryの開発を通じて、どんな学びが得られましたか?
山崎さん
どちらの装置にも、BioStudioシリーズを採用いただいていますね。
山崎さん
ニコンさんのBioStudioシリーズのスタートも、T-Factoryからでしたよね。装置に組み込めること、除染に対応できることを条件に、T-Factoryの自動観察装置としてニコンエンジニアリングさんにつくってもらったのが、BioStudioシリーズの初号機でした。われわれも半導体製造装置のウェハの欠陥やゴミの検査をするための自動観察装置の開発を進めていたんですが、やはりニコンさんの光学系は非常に素晴らしいものでした。
ありがとうございます。最近は、中国で上海睿泰生物科技股份有限公司(以下、ReMed 社)と合弁会社を立ち上げ、白斑治療用の細胞シートを作製する細胞培養装置を開発されていらっしゃいますね。臨床応用も進んでいると聞いています。
山崎さん
導入前の課題
CellShot 48 Plus内でのBioStudio-miniによるタイリング撮影の様子
課題はコンタミの抑制とバラツキの制御
多くの治療実績があるというのは、大きな強みですね。再生医療用の細胞シートを安定して製造できるようになるまでにはさまざまなご苦労があったと思いますが、どんな点が難しかったのでしょうか?
山崎さん
二つあります。一つはコンタミネーションをいかに低減するかという点。もう一つは、患者さんご自身の細胞(自家細胞)を用いた培養では多様なバラツキがあり、いかにそれらを制御して安定した製造を可能にするかという点です。
それらの問題をどう解決されましたか?
山崎さん
コンタミネーション低減については、最大の汚染源は人なので、もっとも有効なのは無人化です。しかし、完全な無人化は不可能です。そこで空気の流れ等を制御して、汚染物質(パーティクル)が細胞に行かないように工夫します。また、100%ノートラブルで動き続ける機械装置は存在しません。例えば落雷による停電など、アクシデントが起きることを前提にして、リカバリーのためのリダンダンシー(冗長性)をあらかじめシステム設計に組み込んでいます。
自家細胞だと培養スケジュールが変更になることもありますよね。
山崎さん
ああ、それもありますね。特に自家細胞を使うと、継代1回目までの増殖速度は実にバラバラです。時には「育ちが悪いので培養時間を1日延ばそうか」というような、ケミカルの世界ではあり得えない変更も生じます。そうした事態にソフトウエアも含めて柔軟に対応できるように配慮しています。
細胞の挙動を学びながら、自動培養装置を開発
細胞のバラツキのお話が出ましたが、安定した細胞製造のためにはどんなことが必要なのでしょうか?
山崎さん
しかし、それでは開発はうまくいきません。そこで、2018年4月に大阪大学に共同研究講座を開設し、実際に自分たちでも細胞に触り、細胞という生物の挙動を学びながら開発を進めることにしました。ここでたくさんのデータを取り、安定した製造を実現するために最適な培養方法を検証しています。培養方法を数値化することで、ある種「マイスター」的な手法からの脱却を目指したわけです。
細胞培養エンジニアリングの確立に欠かせないBioStudio-mini
「マイスター」的な手法ですか?
山崎さん
なるほど。でも、どんな風にどんな加減でかき回しているか、手作業は数値化できませんね。
山崎さん
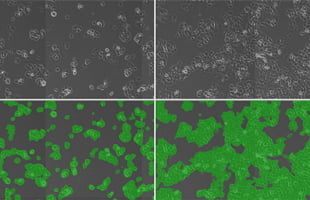
培養工程に、BioStudio-miniを搭載したCellShotと、自動化インキュベータや培地交換装置を一体化したCellKeeper 48Plusを組み込み、進捗を確かめながら工程を柔軟に組める仕組みをつくりました。これによって、出発原料となる細胞の特性にバラツキがあっても、歩留まり良く培養できるようになり、白斑治療用の皮膚シートの生産性は3倍程度に向上し、汚染率は5桁も低減できました。
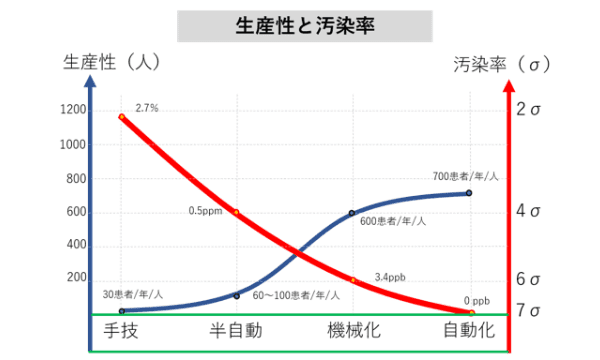
人が介在しないほど汚染の機会は減る。CellKeeper 48Plusの導入による培養工程の半自動化*1により、汚染率は2.7%から0.5ppmに5桁も低減した。生産性については、細胞の増殖は生命現象であり、その速度には上限はあるが、手作業に比較すると機械化*2、自動化*3によって大きく向上している。
*1 半自動化:プロトコールを人と機械が協調して実施する*2 機械化: プロトコール全体は機械が実施するが、必要に応じて人の判断や手作業が入る
*3 自動化: 人手が介在しない状況でプロトコール全体を処理する
導入の効果

CellShot 48 Plusに組み込まれたBioStudio-mini
優れた光学系、コンパクトさ、対応の柔軟さが採用の決め手
御社のCellShotやCellKeeper用の観察装置としてBioStudio-miniを組み込んでいただいたとのことですが、何が採用の決め手になったのでしょうか?
山崎さん
決め手は三つありました。最大の理由はiPS細胞をきちんと見られたのがBioStudio-miniだけだったことです。われわれの方で光学系のアルゴリズムを各社に尋ねて、そのアルゴリズムと実際の見え方を評価した時に、iPS細胞がちゃんと見えたり、観察座標を取得できたりしたのが、ニコンさんだけだったんです。われわれは半導体ウェハの欠陥検査装置を開発販売していましたので、X-Yステージ等の実装も自分たちで対応でき、撮像のソフトウエアやタイリング機能のノウハウも持っていました。ですのでBioStudio-miniを組み込むことで、CellShotを完成させることができました。
二つ目の理由は光学系が非常にコンパクトにまとまっていたことです。
コンパクトさも決め手だったんですね。
山崎さん
はい。CellKeeperは、さまざまな機能を持つ60cm角の各ユニットをおもちゃのブロックのように組み合わせて使用することが開発コンセプトでした。ですので、光学ユニットがコンパクトなBioStudio-miniは限られたスペースに収められる点でも有用でした。ですので、システム化には特に課題はありませんでしたが、強いて挙げると、全面タイリングを行う時には撮像中はインキュベータ外に出すためその温度変化による細胞への影響が課題でしたが、CellKeeperに実装するCellShotモジュールに温度制御とCO2制御を標準実装することで解決しています。
そして三つ目は、ニコンエンジニアリングさんの対応の柔軟さです。インターフェースを含めて、BioStudioをベースにかなり手を入れてもらっています。技術者同士の会話ができ、こちらの要求にきちんと応えていただいた。あの対応がなければ、たぶん今の製品はできていません。One Teamで開発できたことに、とても感謝しています。
ありがとうございます。今の対応のお話は、タイリング撮影機能のないBioStudio-miniを利用しながら、CellShotではタイリング撮影を実現していることと関係していますか?
山崎さん
まさにそれです。タイリング撮影するために、われわれの装置のステージとBioStudio-miniとの間で情報をやり取りしながら、「培養容器が動いたら撮る」という連携を繰り返しているんです。その情報のやり取りをDLL(Dynamic Link Library)化してもらいました。一般的には通信で制御するんですが、プログラム同士で結合させた方がスピーディーだし安定するんです。まあ普通は要求しないし、断られるのが当たり前のような要求でしょうね。でも、対応いただいたおかげでライブ画像を取得でき、われわれの開発した制御ソフトウエアに組み込むことで、直交精度を含めて1ミクロンの精度で撮影位置を制御できるようになりました。このため、CellShotでは非常に高精度なタイリング画像撮影のチューニングが実現できたんです。
全面タイリングのタイムラプス撮影で、「常識」の覆るデータが
実際にどんな風に使っていただいているのですか?
山崎さん
48枚の培養容器(SBS規格、100㎜ディッシュ)を搭載し、すべてのプレートについてそれぞれタイリング画像を取得することで、培養容器の全面でのタイムラプス解析が可能になりました。培養容器内の細胞の分布をマクロ観察するという目的が達成でき、播種した細胞が培養容器内でどのように変化しているかを観察できるようになりました。
最近は弊社の画像解析も取り入れていらっしゃると聞いています。お使いいただいていかがですか?
山崎さん
必須のツールです。CellShotで撮像したタイリング画像のデータは、膨大な枚数になります。例えば数千枚にものぼる画像内の細胞の座標を、一つひとつ手作業でプロットするなんてこと、やりたくないですよね?(笑)
やりたくないし、やったとしてもミスしそうです。
山崎さん
そうですよね。しかも人の目で判断するから、作業者ごとに結果がバラつく。同じ作業者が行っても、その日の体調で結果が左右されることもある。こんなデータでは解析になんか使えません。でも、画像解析を自動化すれば、一つの指標を一定の水準で表現することができるんです。
細胞培養の産業化には、指標づくりに利用できる質の良いデータの蓄積が重要なんですね。
山崎さん
そう思います。CellKeeperでは、培養から培地交換、観察を一体化して安定した細胞培養を可能とし、しかも画像解析まで自動化しています。このため、例えば「播種後、容器を縦に3回揺らす」などのさまざまな操作が、細胞の培養にどのように影響しているかを明らかにできます。実はびっくりする結果が出たんですよ。

細胞培養エンジニアリングへの第1歩
どんなデータが取れたのですか? ぜひ教えてください!
山崎さん
MSC(新生児由来1136株、高齢者由来1146株)を培養する際に、さまざまな操作を行った時と行わなかった時の培養容器内の濃度分布変化を、CellKeeperで7日間、全面タイリングでタイムラプス撮影しました。すると、「最初に播種した状態はマクロ的には何をしても変わらない」ことが分かったんです。ISBF(The International Society for Biofabrication)のオンラインイベント「Call for Abstracts for the 2021 Showcase」で、発表させていただきました。
それはすごい発見ですね。ということは、最初に少し動いたとしてもそれは限られた範囲の中での話であって、播種された時点の濃度分布状態は基本的には変わらないということなんですか?
山崎さん
そうです。例えばディッシュの中央に細胞を含んだ懸濁液を注いだとします。すると細胞の密度は真ん中が濃くて、外が薄くなります。その状態はディッシュを回しても変わらないんです。
回すことで真ん中に寄ってしまうのではなくてですか?
山崎さん
広がらないんです。変わらないんです。逆に端から注いで回したら真ん中に寄るのではという風に普通は考えますが、端に寄ったままなんです。
ということは、最初にいかにムラなく播くかが重要ということなんですね?
山崎さん
その通りです。
びっくりです!
山崎さん
びっくりなんですよ、びっくり。BioStudio-miniを組み込んだCellShotで、すべて自動でデータを取っています。人が介在していない実験ですので、再現性は非常に高い。まさに「マイスター」的手法から細胞培養エンジニアリングへの第1歩を踏み出した。そんな実感があります。
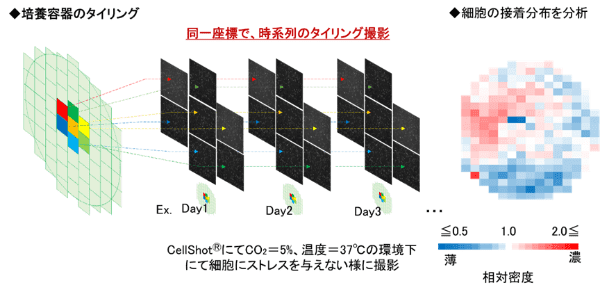
タイリング撮影によって容器内全体の細胞接着分布を評価するとともに、全視野を同一座標でタイムラプス撮影することで分布の変化も評価。
今後への期待

細胞培養装置の真の自動化を目指して
治療の最前線でスピード感をもってさまざまなことに取り組んでいらっしゃいますが、今、新たに取り組んでいらっしゃることで、ご紹介いただけることがあればお聞かせいただけますか?
山崎さん
これまでは「①培養(増殖)」から「②培地交換」、「③観察」、「④解析」等の機械的操作を確立してきました。今後はこれらを一元的に管理し、それぞれの技術をさらにチューニングすることで、培養条件の最適化を追究したいと考えています。
新たな取り組みとしては、継代装置を実用化するため、大阪大学内のラボでMSC(間葉系幹細胞)による開発・検証を進めています、今後は、ReMed社で皮膚細胞を使った検証を行い、臨床データからのフィードバックによって完成を目指す予定です。
継代装置の完成後は、これまでに確立した①~④に「⑤継代」を加え、さらに「AI」を実装して細胞培養装置の真の自動化を目指します。また、前処理や後処理の技術開発についても進めていく予定です。
「細胞培養自動化」という新たな市場をつくりだす
まだ市場のない領域を切り拓いて行くことになりますね。
山崎さん
そうですね。われわれが取り組んでいる細胞培養自動化には、実はまだ市場がないんです。ですから、われわれとしては市場をつくる、あるいは文化をつくるところから挑戦しているところです。よく「ブルーオーシャンを探せ」と言われますが、市場レポートはあまり役には立たないでしょう。そこに書いてある時点で、もう手垢が付いているということです。ですから、ブルーオーシャンはつくり出さなければいけない。そうした目線で見ると、われわれが持っているのは、非常に価値のあるフレッシュな情報なのではないかと思っています。
ニコンもぜひ共有させていただき、皆さんと一緒に細胞医療や再生医療の発展に寄与したいと思います。貴重なお話をありがとうございました。
※掲載した情報は取材当時のものです。※BioStudioシリーズの販売は、2021年4月より、ニコンソリューションズが行っています。また、装置への組み込み対応等のご相談については、ニコンが承っています。
関連事例
関連お役立ち情報
画像解析の技術と品質評価のノウハウで
創薬や細胞培養および様々な研究現場の
課題解決に貢献します。
相談するお問い合わせフォームへ
画像解析トライアルの
お申し込みもこちらから