多能性幹細胞の細胞形態
公開:2020.03.11
多能性幹細胞は、その多能性が日々変化していきますが、多能性を確認する絶対的なマーカーは発見されていません。そこで、多能性幹細胞の多能性を確認するための重要な一つの項目として、細胞形態の観察が挙げられています。ここでは多能性幹細胞の細胞形態と、細胞形態が示す生物学的特性について紹介します。
hPSC(ヒト多能性幹細胞)の細胞形態
多能性幹細胞から分化誘導する際には、その形態を劇的に変化させます。未分化な状態を維持する日々の培養においても、未熟なコロニーから成熟したコロニーへと形態は変化し、また、未分化性は様々な刺激により揺れ動きます。
hPSCの未分化状態で発現するOCT-3/4やNANOGなど様々な未分化マーカー(undifferentiation stem cell marker)が見つかっています。しかし、絶対的な多能性を確認するためのマーカー、つまり、pluriopotent stem cell markerは見つかっていません。*
*undifferentiation stem cell marker をpluriopotent stem cell markerと言い換える近年の傾向がありますが、幹細胞研究者が集まるワークショップなどでは誤解しないようにしてほしいと話題になっています。
そのため、hPSCの多能性を確認するためには、数種類の検査をする必要があります。未分化マーカー遺伝子群や表面抗原の発現などの確認だけでなく、形態的特徴もhPSCの特徴を同定するための重要な項目の一つと考えられています1)。さて、その特徴とはどんなものなのでしょうか? Atlas of Human Pluripotent Stem Cells2)には、
“Undifferentiated PSC colonies typically have clear borders from the feeders and contain small round cells, without spaces between them, and large nuclei with notable nucleoli.”
と記載されています。継代した直後は、輪郭が明瞭な紡錘形や多角形をした細胞が集まって粗な細胞集団のコロニーを形成しています。培養日数とともに細胞が密にパックされた状態になり、細胞と細胞の境界が不明瞭で、細胞質はほとんど見えず核小体が明瞭な核を持つ細胞集団を構成するコロニーへと成長します。タイムラプス撮影を行ってコロニーをトラッキング撮影するとよくわかりますが、細胞の大きさや形態が培養日数とともに変化していきます。顕微鏡で観察する際には、弱拡大でコロニー全体を観察した後、強拡大で細胞と細胞の境界や核の観察を行うとともに、それぞれ弱拡大と強拡大で画像を保存します。
この形態評価は、継代のタイミングを判断するために大変重要です。粗な状態のコロニーを継代で細胞分散してしまうと、継代後に細胞が接着しない、あるいは、分化してしまうことがあります。欧米の幹細胞研究者は、粗な状態のコロニーを「young・若い」、「immature・未熟な」、密に細胞がパックされた状態のコロニーを「mature・熟した」と表現しています。顕微鏡下に容器全体を観察した際に、培養容器底面に細胞のない領域があり、密に細胞がパックされたコロニーができるだけ多くあり、かつ分化しておらず、粗な小さなコロニーができるだけ少ない状態となったと判断したときに、継代します。hPSCの培養において、顕微鏡での細胞観察はとても重要です。
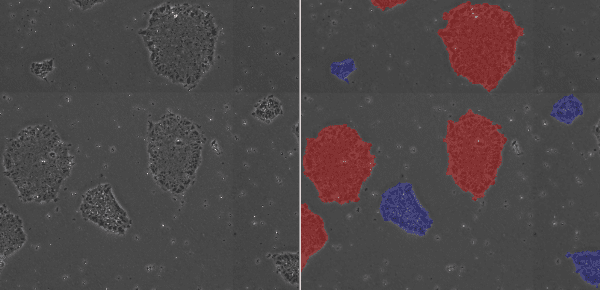
粗な状態のコロニー(青)、密に細胞がパックされた状態のコロニー(赤)
hPSCの細胞形態と生物学的特性との関係
生体を構成する細胞は様々あり、それら由来による培養細胞も様々な細胞の種類があります。それぞれの細胞形態には特徴があります。一般的には、上皮系の細胞は多角形を呈し、間葉系の細胞は長短比が大きく、血球系の細胞は丸いという特徴があります。しかし、これらの特徴的な形態は変化することがあります。よく知られているものとしては、上皮間葉転換(Epithelial-Mesenchymal Transition, EMT)、あるいは、その逆の間葉上皮転換(Mesenchymal-Epithelial Transition, MET)があります。本来多角形を呈している上皮系の細胞が、長短比の大きい間葉系の細胞に転換する、あるいは、その逆が起こります。このような転換は、発生過程において繰り返し行われて組織が構成されていきます3)。中でも有名なのは神経堤(NC: Neural Crest)形成におけるEMTです。神経上皮細胞からEMTにより外胚葉由来間葉系細胞に形質を転換した神経堤細胞(NCC: Neural Crest Cell)が体腔の中に遊走していきます。また、がん細胞の浸潤、転移においても、EMTが大きく関与していることが知られています。EMTにおいては、E-カドヘリンの発現低下、Snail、Slug、TwistなどのEMT関連遺伝子群が発現します4~7)。これらの遺伝子の発現は、TGF-βやWntシグナル、また、EGF、FGFなどの増殖因子により誘導されます。細胞を取り巻く環境からの刺激が細胞の形態を変化させるのです。hPSCが自発的に分化し始める際にもEMTが関与していることが報告されています8~13)。パックされたhPSCコロニーの周辺が分化し始める際、SNAIL や VIMENTINの発現が見られます。
また、hPSCを二次元培養下に、神経幹細胞(NSC:Neural Stem Cell)に分化する過程をタイムラプス画像で撮影したところ、nestin陽性細胞が集まってコロニー様に集合していた状態から、周囲に広がっていく様子が観察されました14)。この様子からEMTが起きていることが予想され、EMT関連遺伝子の発現を調べたところ、E-カドヘリンの発現は低下し、VIMENTINの発現が上昇し、SLUGの発現も一時的に上昇していることがわかりました15)。
以上のように、細胞形態やコロニーの形状は、細胞内のシグナルを反映していることが明らかとなっています。
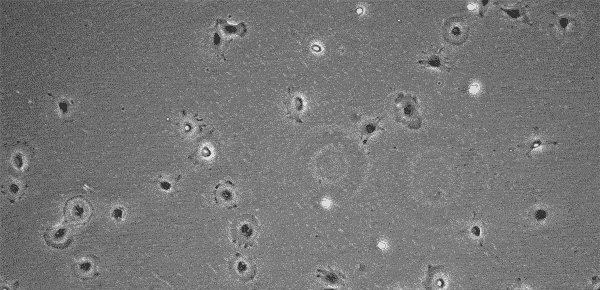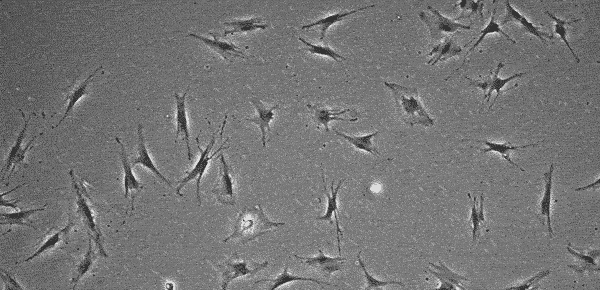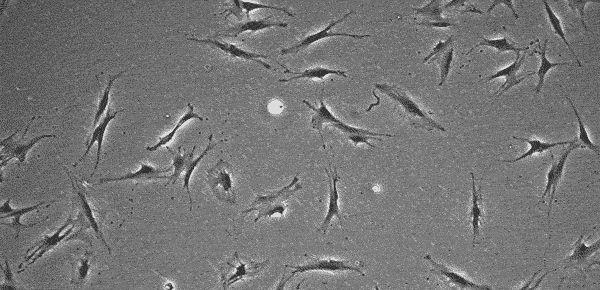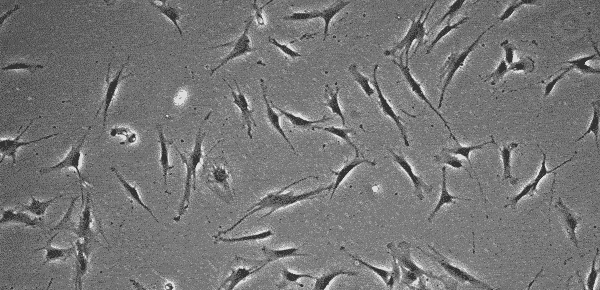
MSC(間葉系幹細胞)の細胞形態
MSCはhPSCのような無限増殖はせず、継代とともに老化してきます。それに伴い細胞形態も変化していきます。いくつかの研究論文では、若い継代数において、「小型で紡錘形の早いサイクルで増殖する細胞」と、より成熟したような「ゆっくりと増殖する大きく扁平な細胞」が見られると報告されています16~18)。MSCはマーカーとしてCD105, CD73, CD90などが必須であると国際細胞治療学会 (International Society for Cellular Therapy: ISCT) では定義されています19)。しかし、これらのマーカーが発現していても増殖する細胞かどうかなどの品質の良さは判断できないため、MSCの品質評価法については国際的に議論になっています20)。また、MSCは由来組織やドナー間での差も大きく、若い継代数であっても細胞増殖せず継代できない場合もあります。どの段階でその培養を中断するかは、作業者に判断にゆだねられているのが現状です。
培養過程の画像を保存し、加えて画像解析により細胞増殖などを数値化することにより、工程管理が可能となり、判断基準の明確化につながると考えられます。このように、品質管理における画像解析の活用が期待されます。
参考文献
1) Stem Cell Rev and Rep. 2009;5:301-314
2) Atlas of Human Pluripotent Stem Cells: Derivation and Culturing.Stem Cell Biology and Regenerative Medicine, New York, Humana Press, 15-39, 2012 (ISBN 978-1-61779-548-0)
3) Cell. 2009;139:871–890
4) J Cell Sci. 2003;116:499-511
5) Cell. 2004;118:277-279
6) Mol Cell. 2001;7:1267-1278
7) J Biol Chem. 2001;276:27424-27431
8) Mol Hum Reprod. 2008;14:169-179
9) Mol Hum Reprod. 2007;13:21-32
10) Stem Cells. 2008;26:2777-2781
11) Cancer Res. 2007;67:11254-11262
12) Stem Cells and Development. 2014;Vol.23, No.18
13) PLoS One. 2013;8: e54122
14) Biol. 2018; 62: 613-621, video S1, S2
15) Int. J. Dev. Biol.62: 613-621 (2018)
16) Mech Ageing Dev. 1981;16:81-89
17) Proc Natl Acad Sci USA. 2001;98:7841-7845
18) Biol. 2011;55:181-187
19) Cytotherapy. 2006; 8: 315–317
20) FORUM. 2014;VOLUME 14,ISSUE 2:141-145



